¿Cómo se Unen los Átomos? Descubre el Proceso de Formación de Moléculas
¿Te has preguntado alguna vez cómo se forman las sustancias que nos rodean? Desde el aire que respiramos hasta los alimentos que consumimos, todo está compuesto por moléculas, las cuales, a su vez, están formadas por átomos. Pero, ¿cómo se unen estos átomos? En este artículo, exploraremos el fascinante proceso de formación de moléculas, entendiendo las distintas formas en que los átomos pueden interactuar entre sí. Este conocimiento no solo es esencial en la química, sino que también nos ayuda a comprender mejor el mundo que nos rodea. A lo largo de las siguientes secciones, abordaremos las distintas fuerzas que hacen posible estas uniones, los tipos de enlaces químicos, y mucho más. Prepárate para un viaje al corazón de la materia y descubre cómo se unen los átomos para crear la diversidad de la vida.
1. La Naturaleza de los Átomos
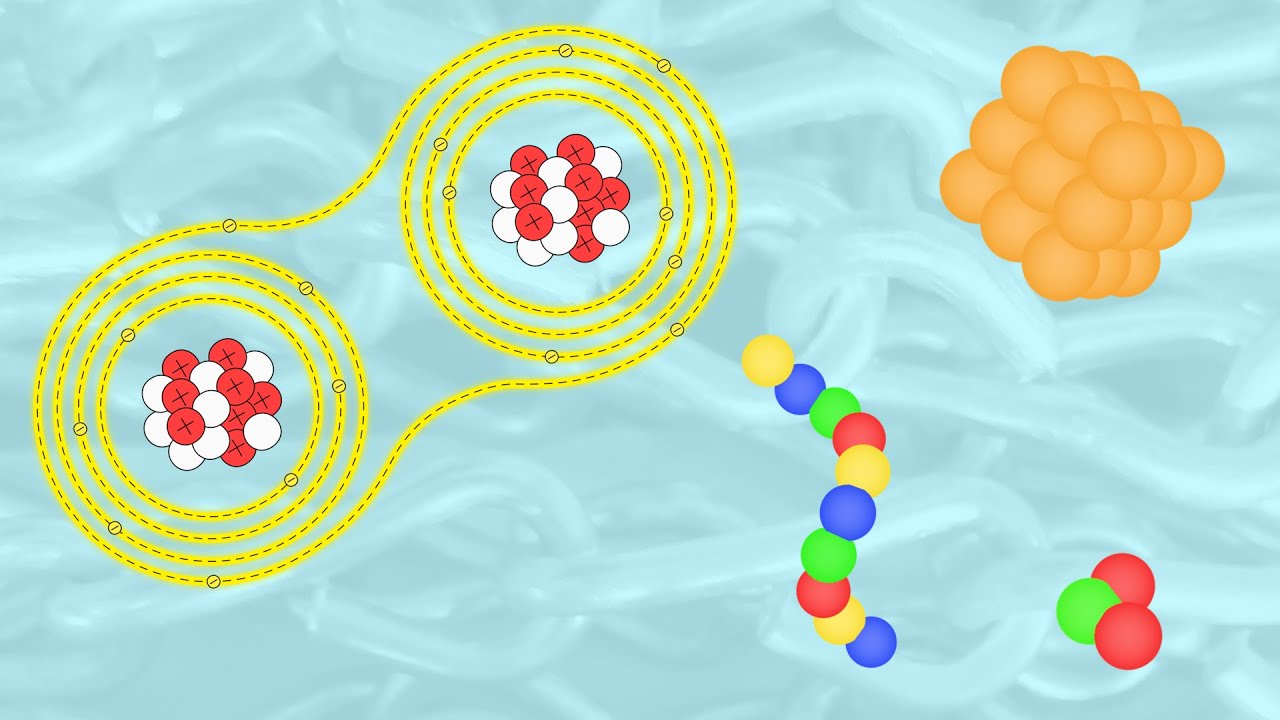
Antes de entender cómo se unen los átomos, es importante conocer qué son y cómo están estructurados. Un átomo es la unidad básica de la materia y está compuesto por un núcleo, que contiene protones y neutrones, y electrones que orbitan alrededor de este núcleo. La interacción entre estos componentes es fundamental para la formación de enlaces químicos.
1.1 Estructura Atómica
La estructura atómica puede ser visualizada como un sistema solar en miniatura. El núcleo, que es extremadamente pequeño en comparación con el tamaño total del átomo, es donde se encuentra la mayor parte de la masa del átomo. Los protones tienen carga positiva y los neutrones son neutros. Los electrones, que tienen carga negativa, se encuentran en órbitas alrededor del núcleo. La configuración de estos electrones es clave para determinar cómo se comporta un átomo en las reacciones químicas.
La cantidad de electrones en la capa más externa de un átomo se llama capa de valencia, y es aquí donde ocurre la magia de la unión atómica. Los átomos tienden a buscar estabilidad, lo que generalmente significa tener una capa de valencia completa. Esto es lo que impulsa a los átomos a unirse entre sí.
1.2 La Importancia de los Electrones de Valencia
Los electrones de valencia son cruciales en la formación de enlaces. Por ejemplo, los átomos de helio tienen una capa de valencia completa, lo que los hace inertes y poco reactivos. En contraste, los átomos de hidrógeno, que tienen un solo electrón en su capa de valencia, están mucho más dispuestos a unirse con otros átomos para alcanzar la estabilidad. Este deseo de completar la capa de valencia es lo que lleva a los átomos a formar enlaces químicos, y es fundamental para entender cómo se unen los átomos.
2. Tipos de Enlaces Químicos
Una vez que comprendemos la estructura atómica, el siguiente paso es explorar los diferentes tipos de enlaces químicos que pueden formarse entre átomos. Existen principalmente tres tipos de enlaces: covalentes, iónicos y metálicos, cada uno con características y propiedades únicas.
2.1 Enlaces Covalentes
Los enlaces covalentes se forman cuando dos átomos comparten electrones. Este tipo de enlace es común entre los no metales. Por ejemplo, en una molécula de agua (H₂O), el oxígeno comparte electrones con los dos átomos de hidrógeno, lo que permite que ambos alcancen una configuración más estable.
Los enlaces covalentes pueden ser simples, dobles o triples, dependiendo de la cantidad de pares de electrones compartidos. Un enlace simple implica un par de electrones, mientras que un doble involucra dos pares. Esta variabilidad en el número de electrones compartidos influye en la fuerza y la longitud del enlace, así como en las propiedades de la molécula resultante.
2.2 Enlaces Iónicos
Los enlaces iónicos se forman cuando un átomo cede uno o más electrones a otro átomo, creando iones con cargas opuestas que se atraen entre sí. Este tipo de enlace es típico entre metales y no metales. Por ejemplo, en el cloruro de sodio (NaCl), el sodio (Na) cede un electrón al cloro (Cl), formando un ion sodio (Na⁺) y un ion cloruro (Cl⁻), que se unen debido a la atracción electrostática.
Los compuestos iónicos tienden a tener altos puntos de fusión y ebullición y suelen ser solubles en agua, lo que los hace muy relevantes en la química de soluciones.
2.3 Enlaces Metálicos
Los enlaces metálicos ocurren entre átomos de metales y se caracterizan por una «nube» de electrones deslocalizados que se mueven libremente entre los átomos. Esta estructura permite que los metales sean buenos conductores de electricidad y calor, además de otorgarles propiedades como la maleabilidad y la ductilidad. Los enlaces metálicos son responsables de la resistencia y la conductividad de materiales como el cobre y el aluminio.
3. La Energía en los Enlaces Químicos
La formación y ruptura de enlaces químicos implica cambios en la energía. Cuando se forma un enlace, se libera energía, lo que generalmente hace que la reacción sea exergónica. Por otro lado, romper un enlace requiere energía, lo que se conoce como energía de activación. Este concepto es fundamental para entender las reacciones químicas y cómo los átomos se unen.
3.1 Energía de Enlace
La energía de enlace es la cantidad de energía necesaria para romper un enlace químico. Cuanto más fuerte es el enlace, mayor es la energía de enlace. Por ejemplo, los enlaces triples son más fuertes que los dobles, y estos, a su vez, son más fuertes que los simples. Esto significa que las moléculas con enlaces más fuertes requieren más energía para ser descompuestas.
3.2 La Relación entre Energía y Estabilidad
La estabilidad de una molécula está relacionada con la energía de sus enlaces. Las moléculas con enlaces más fuertes son generalmente más estables y menos reactivas. Por ejemplo, el gas noble helio es extremadamente estable debido a su configuración de electrones completa, lo que significa que no forma enlaces fácilmente. En contraste, el hidrógeno, que tiene un solo electrón, es muy reactivo y busca unirse con otros átomos para alcanzar la estabilidad.
4. La Formación de Moléculas Complejas
Cuando los átomos se unen, pueden formar tanto moléculas simples como complejas. Las moléculas complejas son esenciales para la vida, ya que forman la base de biomoléculas como proteínas, ácidos nucleicos y carbohidratos. La manera en que los átomos se combinan para formar estas moléculas complejas es un proceso fascinante que involucra múltiples enlaces y estructuras.
4.1 Biomoléculas y su Estructura
Las biomoléculas son compuestos que se encuentran en los seres vivos y son fundamentales para la vida. Por ejemplo, las proteínas están formadas por cadenas de aminoácidos, que son moléculas compuestas por carbono, hidrógeno, oxígeno y nitrógeno. Los enlaces peptídicos, que son un tipo de enlace covalente, unen los aminoácidos entre sí, formando estructuras complejas que determinan la función de la proteína.
4.2 Reacciones Químicas en la Vida
Las reacciones químicas que ocurren en los organismos vivos son un ejemplo de cómo los átomos se unen para formar moléculas complejas. Por ejemplo, durante la fotosíntesis, las plantas convierten el dióxido de carbono y el agua en glucosa y oxígeno, utilizando la energía de la luz solar. Este proceso implica la ruptura y formación de enlaces químicos, ilustrando cómo los átomos se unen y cambian para crear nuevas sustancias.
5. Factores que Afectan la Unión de Átomos
Varios factores influyen en cómo y por qué los átomos se unen. Estos factores incluyen la electronegatividad, la temperatura, la presión y la concentración de reactivos. Comprender estos factores es crucial para predecir cómo ocurrirán las reacciones químicas y cómo se formarán las moléculas.
5.1 Electrones y Electromagnetismo
La electronegatividad es una medida de la capacidad de un átomo para atraer electrones. Los átomos con alta electronegatividad, como el oxígeno y el flúor, son más propensos a formar enlaces covalentes con otros átomos. Esta propiedad influye en el tipo de enlace que se forma; por ejemplo, un átomo de sodio (bajo en electronegatividad) y un átomo de cloro (alto en electronegatividad) forman un enlace iónico, mientras que dos átomos de oxígeno formarán un enlace covalente.
5.2 Condiciones Ambientales
Las condiciones ambientales también juegan un papel crucial en la formación de enlaces. La temperatura y la presión pueden alterar la energía de los átomos y su capacidad para unirse. Por ejemplo, en condiciones de alta temperatura, los átomos pueden moverse más rápidamente y tener más energía, lo que puede facilitar la ruptura de enlaces existentes y la formación de nuevos enlaces. Del mismo modo, un aumento en la concentración de reactivos puede aumentar la probabilidad de que los átomos se encuentren y se unan.
6. Implicaciones de la Unión de Átomos en la Ciencia y la Tecnología
La comprensión de cómo se unen los átomos no solo es fundamental para la química, sino que también tiene aplicaciones en diversas disciplinas, desde la biología hasta la ingeniería de materiales. La manipulación de átomos y moléculas ha llevado a avances significativos en la medicina, la energía y la tecnología de materiales.
6.1 Avances en Medicina
En medicina, el conocimiento de cómo se unen los átomos ha permitido el desarrollo de medicamentos y tratamientos innovadores. Por ejemplo, los fármacos a menudo se diseñan para interactuar con moléculas específicas en el cuerpo, aprovechando el conocimiento sobre enlaces químicos para crear compuestos que se unen eficazmente a sus objetivos biológicos.
6.2 Nuevos Materiales y Energía
En el ámbito de la ingeniería, la manipulación de enlaces químicos ha permitido la creación de nuevos materiales con propiedades deseadas, como la resistencia, la ligereza y la conductividad. Por ejemplo, los nanomateriales, que son estructuras a escala nanométrica, se diseñan aprovechando la química de los enlaces atómicos para mejorar la eficiencia de dispositivos electrónicos y paneles solares.
FAQ (Preguntas Frecuentes)
¿Qué es un enlace químico?
Un enlace químico es la fuerza que une a los átomos en una molécula. Puede ser covalente, iónico o metálico, dependiendo de cómo se comparten o transfieren los electrones entre los átomos. Esta unión es fundamental para la formación de compuestos y sustancias que encontramos en la naturaleza.
¿Por qué los átomos se unen?
Los átomos se unen principalmente para alcanzar una configuración electrónica más estable. Esto generalmente implica completar su capa de valencia, lo que les proporciona una menor energía y, por lo tanto, mayor estabilidad. Este deseo de estabilidad es lo que impulsa la formación de enlaces químicos.
¿Qué es un enlace covalente?
Un enlace covalente se forma cuando dos átomos comparten uno o más pares de electrones. Este tipo de enlace es común entre no metales y puede ser simple, doble o triple, dependiendo de la cantidad de electrones compartidos. Los enlaces covalentes son fundamentales para la formación de muchas moléculas biológicas y químicas.
¿Cómo afectan la temperatura y la presión a la unión de átomos?
La temperatura y la presión pueden influir en la energía de los átomos y su capacidad para unirse. A temperaturas más altas, los átomos se mueven más rápido, lo que puede facilitar la ruptura de enlaces existentes y la formación de nuevos. Aumentar la presión puede comprimir los átomos y aumentar la probabilidad de que se unan.
¿Qué son las biomoléculas?
Las biomoléculas son compuestos que se encuentran en los organismos vivos y son esenciales para la vida. Incluyen proteínas, carbohidratos, lípidos y ácidos nucleicos, cada uno formado por la unión de átomos de diferentes elementos. Estas moléculas son responsables de las funciones biológicas y metabólicas en los seres vivos.
¿Cuál es la diferencia entre un enlace iónico y un enlace covalente?
La principal diferencia entre un enlace iónico y un enlace covalente radica en cómo se manejan los electrones. En un enlace iónico, un átomo c